Come può la variabilità genetica influenzare la risposta ai farmaci. La ricerca di Melissa Drago, biologa e dottoranda di Unict
Nel V secolo a.C., il celebre sofista Protagora affermava che «l’uomo è la misura di tutte le cose, e non esiste un metro di giudizio assoluto ma un rapporto non uguale per tutti che può cambiare». Seppur datata, l’accezione relativista di tale pensiero si avvicina molto ai bisogni della società odierna, attenta alle necessità individuali ed impegnata nella personalizzazione dei servizi.
Negli ultimi vent’anni anche la medicina ha assunto un orientamento più soggettivo e ad oggi è sempre più diffuso il concetto di medicina di precisione che rappresenta un nuovo modo di prevenire e trattare le malattie, in quanto permette al medico di adottare una strategia terapeutica ‘su misura’, disegnando percorsi di cura individuali e personalizzati.
Come riportato in un recente articolo (Pulciani et al, Ann Ist Super Sanità 2017, Vol. 53, No. 3: 185-191 DOI: 10.4415/ANN_17_03_02), la medicina del ventunesimo secolo deve ambire al raggiungimento delle 4P - predizione, prevenzione, personalizzazione e partecipazione - allo scopo di dare il giusto farmaco alla persona giusta nel momento giusto. Tale necessità è dovuta a un’evidenza clinica nota da tempo, ovvero: soggetti diversi rispondono in modo diverso allo stesso farmaco. Alcuni risponderanno bene e rapidamente, altri solo in parte e altri ancora non trarranno alcun beneficio, ma addirittura manifesteranno eventi avversi talmente gravi da dover sospendere e/o cambiare la terapia.
Figura 1 - Medicina di precisione
Come si spiega questa variabilità inter-individuale? Fino a qualche anno fa era attribuita a fattori come l’ambiente, l’età, il sesso, lo stile di vita. Oggi sappiamo che in essa giocano un ruolo molto importante anche i geni che costituiscono il nostro DNA. Ciascuno di noi possiede un corredo di geni unico che lo rende differente dagli altri individui ed è responsabile della variabilità genetica. In questa prospettiva, sono fondamentali gli studi di farmacogenetica.
La farmacogenetica è la principale area di applicazione della medicina di precisione, e ha l’obiettivo di capire come le differenze genetiche possono influenzare la risposta a un determinato farmaco. Per far ciò si avvale dell’esecuzione di test che individuano specifiche variazioni del DNA e i relativi risultati, combinati agli esami biochimici ‘tradizionali’ e alla storica clinica del paziente (anamnesi), indirizzano il medico a una terapia mirata per malattie che vanno dall’AIDS al cancro.
Nel progetto di ricerca si sta valutando la validità e l'efficacia clinica di test genetici di screening a cui vengono sottoposti i pazienti oncologici che devono iniziare il trattamento con 5-fluorouracile (5-FU) e irinotecano. Si tratta di due chemioterapici molto tossici utilizzati in prima linea per la terapia del cancro colon-rettale.
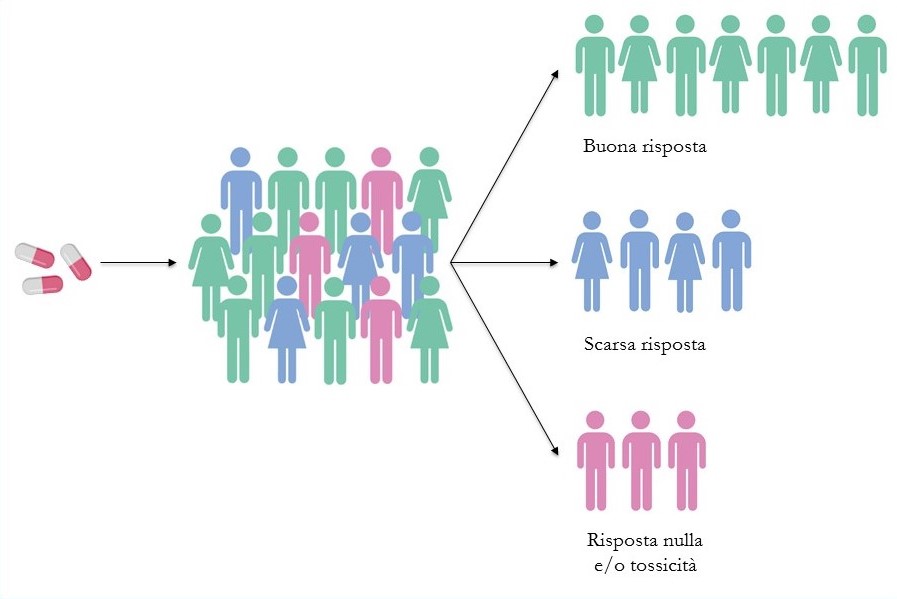
Figura 2 - Farmacogenetica
I pazienti, sotto prescrizione medica, possono accedere agli esami genetici eseguendo un semplice prelievo venoso periferico da cui viene isolato il DNA.
L’analisi del DNA prevede lo screening dei geni DPYD e UGT1A1 investigati per valutare la presenza di varianti (causate da mutazioni). Questi geni codificano gli enzimi responsabili dell’eliminazione dei farmaci 5-FU e irinotecano, principalmente a livello epatico. La presenza di mutazione in uno dei due geni causa il mal funzionamento del relativo enzima e, di conseguenza, l’accumulo del farmaco che, dopo aver esaurito il suo effetto benefico, sarà causa di tossicità di tipo cutaneo, ematologico, neurologico e gastro-intestinale.
Se molto gravi, queste tossicità possono compromettere la sicurezza e l’efficacia della terapia perché ne determinano la sospensione e/o interruzione.
Obiettivo principale dello studio è quello di valutare il potenziale beneficio, la fattibilità, la sicurezza e l’efficacia clinica dello screening genotipico per le varianti dei suddetti geni. Ulteriore scopo è quello di correlare il profilo genetico del paziente con l’incidenza di tossicità gravi manifestate durante il trattamento chemioterapico. I dati ottenuti verranno infine utilizzati per ottimizzare il dosaggio da somministrare tenendo conto delle raccomandazioni nazionali per le analisi di farmacogenetica.
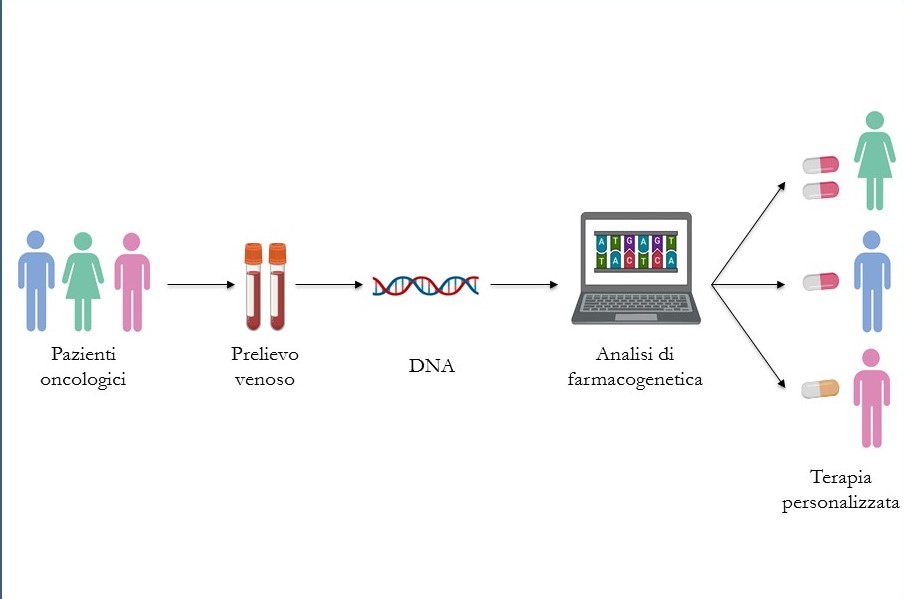
Figura 3 - Le diverse fasi della ricerca
Prevenire e minimizzare la frequenza di insorgenza di tossicità gravi per garantire la continuità terapeutica è la chiave fondamentale per assicurare al paziente la possibilità che la terapia risulti giusta, sicura, tollerabile ed efficace.
Grazie alle conoscenze pregresse, le tecnologie all’avanguardia e all’ottimo team di lavoro al Centro di Oncologia ed Ematologia Sperimentale (COES) è possibile identificare 5 varianti del gene DPYD e 5 varianti di UGT1A1, riconosciute come marcatori predittivi di tossicità. La loro analisi consente di ‘stratificare’ i pazienti in due gruppi: portatori della mutazione (eterozigoti o omozigoti) e pazienti non mutati (wild type). Il parere ultimo del Centro di Riferimento di Farmacovigilanza fornirà la giusta direttiva all’oncologo per scegliere la dose di chemioterapico da somministrare.
Questo progetto conta di arruolare almeno 400 pazienti ed è il primo studio di questo genere condotto su una coorte di pazienti provenienti dalla Sicilia orientale. Il fine ultimo non è solo quello di ottimizzare la risposta farmacologica dei pazienti oncologici, ma in particolare quello di ‘puntare un riflettore’ sull’importanza dei test genetici e sensibilizzare le strutture sanitarie ad investire sul benessere dei pazienti non solo in termini di cure, ma soprattutto di prevenzione.

In foto da sinistra Michele Massimino, Stefania Stella, Silvia Vitale, Livia Manzella, Melissa Drago, Cristina Tomarchio, Marzia Costanzo e Antonio Sollima
L’attività di ricerca è condotta dalla dott.ssa Melissa Drago, in qualità di biologa e dottoranda in Biomedicina Traslazionale del Dipartimento di Medicina Clinica e Sperimentale dell’Università di Catania, al Centro di Oncologia ed Ematologia Sperimentale (COES) dell’Azienda ospedaliero-universitaria Policlinico “Rodolico-San Marco” di Catania coordinato dal prof. Paolo Vigneri e dalla prof.ssa Livia Manzella.
Il progetto prevede la partecipazione della dott.ssa Silvia Rita Vitale e coinvolge attivamente anche la Unità operativa di Oncologia diretta dal dott. Hector Soto Parra e il Centro di Riferimento Regionale di Farmacovigilanza diretto dal prof. Filippo Drago.